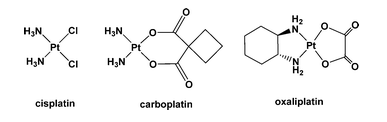
백금 기반 항암제인 시스플라틴(cisplatin), 카보플라틴(carboplatin), 옥살리플라틴(oxaliplatin)은 효과적이지만 심각한 용량 제한 부작용으로 인해 사용이 제한된다.
시스플라틴에 대한 용량 제한 부작용은 신독성이고, 카보플라틴에 대한 것은 골수 억제이며, 옥살리플라틴에 대한 것은 신경독성이다.
백금 기반 항암제의 일반적인 부작용으로는 아나필락시스, 세포감소증(백혈구감소증, 혈소판감소증, 빈혈 포함), 간독성, 이독성, 심장독성, 메스꺼움과 구토, 설사, 점막염(mucositis), 구내염, 통증, 탈모, 악액질(cachexia; 지속적인 체중 감소와 식욕부진, 지방 조직 및 근육의 쇠퇴, 영양학적 대사 불균형 등을 초래하는 증후군), 쇠약(asthenia)이 포함된다.
부작용으로 인해 환자들은 25~100% 사이의 백금 기반 항암제의 용량 감소가 필요해진다. 게다가, 환자들은 그들의 생화학, 신장 및 간 기능에 대한 광범위한 모니터링을 필요로 하며, 약물에 따라 청력 검사를 필요로 한다.
마지막으로, 환자들은 일반적으로 antiemetics, antibiotics and myeloid growth factors, mannitol, propafenone, saline hyperhydration, magnesium supplements, monoclonal antibody cytokine blockers, and antioxidants를 포함할 수 있는 부작용을 예방 및 치료하기 위해 추가적인 약물이 필요하다.
<백금 기반 항암제>



약물의 메커니즘:
soft nucleophile로써, 시스테인 또는 메티오닌의 황 잔기, 특히 항산화 펩타이드 글루타티온(antioxidant peptide glutathione)을 포함하는 펩타이드와 단백질에 쉽게 결합한다.
주로 약물은 구아닌의 N7 위치에 결합하지만, 아데노신 잔기도 결합하여 DNA의 이완 및 굽힘을 유발한다. 궁극적으로, 이것은 DNA 전사 및 복제를 방지하여 (정상세포 or 암세포) 세포를 죽음에 이르게한다.
백금 기반 약물 치료의 주요 한계는 바로 내성이다. 이미 내성이 있거나 치료 중 내성이 생기는 경우가 있다.
약물 독성 메커니즘(The mechanism of platinum-drug toxicity)
백금계 약물을 포함한 모든 세포독성 화학요법 약물은 정상 조직보다 암 조직에 대한 선택성이 떨어져 다양한 심각한 부작용을 보인다. 약물이 가지는 선택성이라고는 암세포의 높은 영양분 요구량이 고작이다. 따라서 빠르게 성장하는 암세포에 의해 흡수되는 동안, 이 약물들은 빠르게 성장하는 다른 정상 조직으로도 흡수되어 부작용을 야기한다.
화학요법 약물의 영향을 받을 수 있는 빠르게 성장하는 조직에는 구강, 목, 위장관의 점막이 포함되어 위장관 부작용을 일으킨다. 또한 골수도 이에 해당되므로 백혈구와 적혈구 생산을 감소 부작용이 나타날 수 있다. 모낭 역시 빠르게 자라는 세포에 포함되므로 화학요법 약물로 인해 눈썹, 얼굴, 몸의 털이 포함된 모발이 빠지는 탈모는 물론 귀에 있는 모낭이 빠져 이독성(귀 손상)이 발생할 수 있다. 마지막으로, 화학요법 약물은 일반적으로 신독성(신장 손상)과 간독성(간 손상)을 나타내는 것으로 알려져 있다. 신장 손상은 소변에서 약물의 배설이 일어나기 때문이고 간 독성은 간에서 약물의 대사와 해독되기 때문이다.
백금 약물의 독성과 반응성(reactivity) 사이에는 직접적인 연관성이 있다. 백금 약물의 반응성(체내의 생체분자에 얼마나 빨리 결합하는가)은 주로 백금 약물의 이탈기가 얼마나 불안정한가에 의해 결정된다. 그룹이 더 불안정할수록, 복합체는 더 반응성이 높다.
carboplatin의 개발은 이러한 구조-활성 관계에 직접적으로 기반을 두었다. cisplatin의 염화(Cl) 리간드를 carboplatin의 bis-carboxylate 리간드로 대체하면 cisplatin과 비교했을 때 aquation 속도가 현저히 감소하고, 따라서 독성이 감소한다.
백금 약물의 부작용을 줄이는 데 중요한 측면은 약물 준비 및 투여 과정에서 최소한의 수분 공급이 이루어지도록 하는 것이다. cisplatin은 염화 리간드의 제거를 늦추기 위해 항상 0.9% 생리식염수(NS) 용액에 희석해야 한다. NS에서 carboplatin 또는 oxaliplatin을 희석하면 약제들은 carboplatin → cisplatin으로 전환되고, oxaliplatin은 모약물보다 반응성이 높고 용해성이 낮은 [PtCl2(R,R-dach)]로 전환될 것이다. 따라서 carboplatin은 NS보다 5DW에 희석이 권장되고 oxaliplatin은 5DW에 희석해야 한다.
<희석에 대한 국내 허가사항>


특이 부작용
1. 신독성
cisplatin의 가장 일반적인 신독성 부작용은 급성 신부전(급성 신부전으로도 알려져 있음)과 저마그네슘혈증으로 cisplatin 치료 환자의 90%까지 영향을 미치는 것으로 보고되었다. 저마그네슘혈증은 손상된 신장이 마그네슘을 재흡수하지 못하는 데서 비롯된다.
어떻게 신독성을 유발하는지 완전히 이해되지는 않았지만, 신장에 대한 직접적, 간접적인 손상 때문인 것으로 추정된다. 주요 메커니즘은 근위세뇨관세포의 급성세뇨관괴사에 기인한다.
신독성은 화학요법 주기의 횟수와 용량에 따라 위험도의 정도가 관련된다. cisplatin으로 인한 신장 손상의 위험은 약물을 bolus 주사가 아닌 느린 주입으로 투여할 때 감소한다. 환자에 따라, 그들의 신독성은 가역적일 수도 있고 그렇지 않을 수도 있다.
신독성이 발생할 추가적인 위험 요소
- 기존 신장 기능 장애
- 고혈압(고혈압)
- 여성
- 나이
- 흡연 이력
- 병용 약물(신독성 약물): NSAIDs계 항염증제, aminoglycoside계 항생제(based gentamicin), cephalosporin계 항생제(based cefalotin antibiotics), 다른 화학 요법 항암제(fosfamide, methotrexate)
- 당뇨병: 문헌에는 당뇨병이 신장독성을 경험하는 환자의 위험에 증가하는지 또는 영향을 미치지 않는지에 대한 논쟁이 있다.
신독성 예방법
- 충분한 수액 공급
- 마그네슘 공급
- 구토로 인한 체액 손실을 예방하기 위한 항구토제
- 이뇨제: 이점에 대한 논란이 있음
- ACEI, CCB: 해당 약제들이 cisplatin에 의한 신독성(GFR이나 신장 혈류량 감소)을 역전시키지는 못함
2. 이독성
환자의 청력과 균형에 손상을 초래하는 내이의 손상이다. 주요 이독성은 양쪽 귀의 영구적인 청력 손실이지만, 귀 통증, 이명, 전정 변화(균형 감각)가 포함될 수 있다. 난청은 환자가 화학 요법을 시작하기 전에 청력 기준이 설정된 경우 청력 검사를 통해 평가하거나 환자의 청력 자체 평가를 통해 평가한다.
cisplatin의 경우 청력 손실은 일반적으로 높은 주파수(>4 kHz)에서 발생하며 약물의 선량/누적 선량에 비례한다. 난청률은 약물 투여량과 환자의 연령에 따라 매우 다양하며 4~90% 사이이다. 난청은 시스플라틴 투여량이 60mg/㎡보다 크거나 높은 주파수에서 일반적으로 발생한다.
백금 항암제로 인한 이독성은 여러 메커니즘을 통해 내이의 손상에 기인하는 것으로 생각된다. cisplatin은 특히 니코틴아마이드 아데닌 다이뉴클레오타이드 인산(NADPH) 산화효소를 통해 ROS를 생성할 수 있는 달팽이관 조직에 축적되는 것으로 알려져 있으며 글루타티온 환원효소, 퍼옥시다아제, 카탈라아제 및 슈퍼옥사이드 디스무타아제와 같은 중요한 항산화 효소를 하향 조절한다. 또한 시스플라틴 유도 이독성은 난포 아포토시스를 유발하는 큰 전도성 칼륨 채널을 활성화하는 약물에 기인하는 것으로 생각된다.
백금계 항암제의 이독성을 관리하거나 감소시키는 효과적인 방법은 없다. 부작용 메커니즘으로 생각되는 ROS 생성을 고려할 때, 귀의 손상을 줄이기 위한 N-acetyl cysteine, sodium thiosulphate and amifostine과 같은 항산화제의 유용성에 대한 여러 연구가 있었지만, 이들 중 어느 것도 광범위한 임상적 사용을 얻지 못했다.
3. 신경독성
신경 독성은 주로 말초 감각 신경 장애(peripheral sensory neuropathy, PSN; pain, weakness or numbness in the hands or feet)이다. cisplatin의 알려진 부작용이지만 oxaliplatin 치료와 더 관련이 있다. 치료를 받은 환자의 60~95%는 3등급 또는 4등급의 신경 독성을 경험한다. 부작용의 발생률은 누적 선량에 따라 증가한다. 만성 PSN은 일반적으로 cisplatin의 경우 500 mg/㎡, oxaliplatin의 경우 750 mg/㎡를 초과하는 누적 선량으로 환자를 치료할 때 발생한다.
부작용은 가역적이며 며칠 후에 급성 또는 만성이 될 수 있으며, 만성 증상은 최대 4년 동안 지속되는 것으로 보고된다. 증상은 환자의 손, 발, 입 및 인후두 주변부에서 더 악화되는 경향이 있으며, 저림, 따끔거림, 간지러움 또는 타는 듯한 감각을 포함하는 감각으로 나타난다. 추위에 노출되면 신경독성 부작용이 증가하는 것으로 알려져 있다.
신경 독성을 예방하거나 조절하는 효과적인 치료법은 거의 없다. 칼슘이나 마그네슘의 주입이 부작용을 감소시키는지와 이러한 주입이 옥살리플라틴의 효과를 감소시키는지에 대한 문헌은 일관성이 없다.
acetylcysteine, vitamin E, diethyldithiocarbamate, amifostine, oxycarbazepine, and glutathione과 같은 항산화제의 사용 효과가 없는 것으로 나타났다.
4. 심장독성
전기생리학적 변화를 통해 심장 근육에 직접적인 손상을 입히거나 심장의 sinus 리듬에 영향을 미치는 간접적인 손상을 포함한다.
심장 독성은 백금계 항암제의 일반적인 부작용은 아니지만 지난 10년 동안 cisplatin 주입 중 또는 직후에 발생하는 광범위한 심장 독성 사건을 보고하는 임상 사례의 수가 증가하였다.
예> silent and symptomatic arrhythmias (abnormal heart rhythm), cardiac ischemia (inadequate blood supply to the heart), diastolic disturbances (the ventricles do not properly relax before the next contraction), myocardial infarction (heart attack), angina, pericarditis (inflammation of the pericardium which is the sac-like tissue that surrounds the heart), thromboembolic events (obstruction of a vessel in the heart or veins), and chronic heart failure
cisplatin과 비교하여 oxaliplatin 또는 carboplatin에 의해 유도된 심장 독성에 대한 임상 보고는 거의 없다. 다른 화학 요법 약물과 달리 백금계 항암제를 투여할 때 일반적으로 심장 모니터링은 하지 않으므로, 이는 특히 증상이 경미하거나 이러한 약물에 의해 단기 및 장기적으로 유발되는 심장 독성의 보고 부족을 초래했을 수 있다.
5. 혈액학적 독성
세 가지 백금계 항암제 약물 모두 혈액학적 독성을 일으키는 것으로 알려져 있으며, 골수 억제는 carboplatin의 용량 제한 독성이다. 혈액독성의 위험인자로는 신장기능, 연령, 인종 등이 있으며, 부작용의 심각성은 약물복용량과 직접적으로 연관되어 있다.
이러한 부작용들은 환자들을 어지럽히고, 피곤하고, 무기력하게 만들 수 있고, 그들이 백혈구 감소증이나 호중구 감소증을 경험할 때, 그들을 감염에 취약하게 하고 그들의 입원 기간을 증가시킬 수 있다.
6. 간독성
화학 요법 약물에 의해 유발될 수 있는 간 손상의 종류는 다르지만, cisplatin and oxaliplatin은 간 sinusoids를 손상시킨다. 간에 산소를 공급하는 혈관 폐색을 초래하여 간 기능 저하를 초래한다. 간독성의 비율은 백금 약물마다 다르지만 oxaliplatin의 경우 10~50% 사이이다.
백금계 항암제 유도 간독성에 대한 치료는 손상 징후를 모니터링하고(간 기능 검사) 환자의 치료 기간을 제한하는 것 외에는 확립된 치료법이 없다. 항산화제를 투여하면 손상을 줄일 수 있다는 증거는 제한적이다. 그러나 백금계 항암제 약물에 의해 생성된 ROS가 사이토카인 증가를 초래하기 때문에 종양괴사인자-α(tumour necrosis factor-α)의 작용을 차단하는 infliximab과 같은 사이토카인을 막는 약물의 공동 투여는 간 손상을 제한하는 데 유용할 수 있다.
7. 위장관 독성
주로 화학 요법 유도 메스꺼움(CINV) 및 구토과 소화불량과 같은 구토를 포함한다.
cisplatin은 환자의 90% 이상이 메스꺼움과 구토를 경험할 것으로 예상되는 고위험 구토제로 꼽힌다. 대조적으로, carboplatin과 oxaliplatin은 모두 메스꺼움과 구토율이 30~90% 사이인 중간 위험 약물로 평가된다. 백금 약물과 함께 방사선 치료를 공동 투여한다면, 이것은 CINV의 발생을 증가시킬 수 있다. 구토억제제를 사용한 치료는 대부분 성공적이지만, 환자의 10-30%는 여전히 메스꺼움과 구토를 경험한다.
환자의 대부분의 CINV는 백금계 항암제가 위장관의 세포를 공격할 때 5-HT의 방출에 기인한다. 방출되면 5-HT는 세로토닌 수용체, 특히 5-HT3 수용체(중추신경계와 말초신경계에 존재)에 결합하여 이는 CINV로 이어진다. 5-HT3 수용체 길항제인 구토억제제는 5-HT의 결합을 차단하고, 이를 통해 메스꺼움과 구토를 유발하는 일련의 효과를 차단한다.
reference:
1) Oun, Rabbab, Yvonne E. Moussa, and Nial J. Wheate. "The side effects of platinum-based chemotherapy drugs: a review for chemists." Dalton transactions 47.19 (2018): 6645-6653.
'🤹♂️ 카테고리별 약물 > 항암·보조요법' 카테고리의 다른 글
| 항암제 과민반응, 탈감작요법 : desensitixation, drug hypersensitivity (0) | 2023.01.02 |
|---|---|
| Chemotherapy-induced diarrhea, 항암제 부작용: 설사, loperamide, octreotide (0) | 2022.12.26 |
| Bevacizumab, wound healing : 상처 지연, 외과적 수술 전 주의 항암제 (0) | 2022.12.08 |
| 유방암 환자에서 trastazumab 정맥주사 vs 피하주사 차이: 허셉틴 주, ANAPA 주입기기 (0) | 2022.09.12 |
| 항암제 생리식염수(NS) 재구성 약물 (0) | 2022.08.07 |


댓글