Refeeding syndrome이란?

심각한 영양실조 또는 중증의 질병으로 인해 신진대사에 스트레스를 받는 환자들이 기아 상태(starvation)에서 영양 초기 단계에서 나타날 수 있는 증상/징후이다.
혈당 증가, 전해질 불균형(특히 저인산혈증, 저칼륨혈증, 저마그네슘혈증), 비타민 고갈(특히 비타민 B1; thiamine). 염분 저류 등을 특징으로 하며 이로 인해서 장기 부전, 부정맥 등을 유발할 수 있다.
The awareness of the medical and nursing staff is often too low in clinical practice, leading to under-diagnosis of this complication, which often has an unspecific clinical presentation. This review provides important insights into the RFS, practical recommendations for the management of RFS in the medical inpatient population (excluding eating disorders) based on consensus opinion and on current evidence from clinical studies, including risk stratification, prevention, diagnosis, and management and monitoring of nutritional and fluid therapy.
= refeeding syndrome에 대한 명확한 이해를 통해 예방, 진단, 관리 및 모니터링에 힘쓰자!
1. Pathophysiology and Clinical Manifestations
장기간 기아 상태(prolonged phase of starvation or scarce food intake) 이후 포도당 도입으로 인한 과장된 생리학적 반응이다. 정확한 병리학적 기전은 여전히 불분명하지만 최근의 가정은 위의 그림에 기술되어 있다.
이화 상태(기아 상태거나 음식 섭취의 감소로 인한)에서는 인슐린(insulin) 합성이 감소되는 반면 글루카곤(glucagon)과 카테콜아민(catecholamine)의 약간 자극된다.
단식기간동안 포도당 산화가 감소하며 glucose-dependent tissue인 뇌, 신수질(renal medulla), 적혈구만이 포도당 산화가 발생한다.
글리코겐(glycogen) 저장이 감소되고 이는 포도당신생합성(gluconeogenesis)의 활성화와 내인성 아미노산으로부터 포도당을 합성(단백질 분해; proteolysis)을 유도한다. 이 과정은 근육량 감소와 체중 감소를 유발한다. 뿐만 아니라 비타민과 전해질 수치가 감소하고 이들의 저장소가 고갈된다. 이 상태로 며칠이 지속되면 지방 분해가 증가되어 결과적으로 순환하는 유리 지방산(free fatty acid) 수치가 증가된다. 유리 지방산은 간에서 케톤 생성을 자극하여 케톤체(in particular acetoacetate and beta-hydroxybuturate)의 증가를 유발하며 이는 인체의 주요 에너지 공급원이 된다. 이화 상태 동안은 정상 상태의 30-50%정도 대사 과정이 감소된다.
요약:
단식 상태 ⇨ 포도당 산화 감소 ⇨ 포도당 신생합성 증가/단백질 분해 ⇨ 단식 상태 지속 유지 ⇨ 지방 분해 증가(유리 지방산 증가) ⇨ 케톤체 생성(주 에너지원) ; 이화 상태는 정상 상태에 비해 대사 과정이 감소됨
이 때 탄수화물을 포함한 균형 잡힌 영양 지원이 도입되면 포도당은 다시 주요 에너지 공급원이 된다. 이에 고혈당증이 유발되고 결과적으로 인슐린 분비가 증가된다.
동화 과정(anabolic processes)이 자극되어 포도당, 수분, 전해질의 세포 내 이동으로 인해 잠재적으로 혈장의 이 수치들의 심각한 감소가 야기될 수 있다. 그 결과 전해질 불균형이 발생하여 부정맥, 경련 등의 합병증이 나타난다.
산-염기 균형은 상당한 전해질 불균형을 일으킬 수 있으며 이는 refeeding syndrome이 의심될 때(e.g., respiratory acidosis) 진단 혹은 원인으로 간주해야한다.
산증 상태에서 인산염, 칼륨, 마그네슘 수치가 유의하게 하락할 수 있다. 포도당의 세포 내 이동은 티아민(thiamin)에 의존하기 때문에 티아민 결핍은 이화 작용 중 관찰될 수 있으며 이는 각기병 증상으로 이어질 수 있다. 영양 상태가 더 불량할수록 refeeding syndrome의 위험이 높고 증상이 더 심각하다.
| Phosphate | 에너지 생산 및 운송 과정에 중요한 전해질 당분해 과정 시 인산화 포도당이 요구되기 때문에 인산염은 포도당 분해과정에 필수적임 저인산혈증으로 횡문근융해증, 용혈, 호흡곤란 등 여러 가지 임상적 징후를 유발할 수 있음 중증 저인산혈증(0.32mmol/L=1 mg/dL)은 대표적인 특성 |
| Potassium and magnesium | 세포 내의 중요한 양이온 중즘 저칼륨혈증 또는 저마그네슘혈증은 잠재적으로 치명적인 부정맥, 신경근 부전을 유발함 |
| Thiamine | 탄수화물 신진대사에 필수적인 조효소 티아민 부족 시(인체 저장이 약 14일 지속됨) 포도당이 젖산염(lactate)으로 전환돼 대사 산증을 야기함 |
| Sodium | refeeding phase동안 칼륨의 세포내 이동으로 인한 나트륨의 세포 밖으로 유출(sodium-potassium-ATPase pump)로 나트륨 수치에 영향을 끼침 뿐만 아니라 초기 refeeding phase에는 신장에서의 나트륨 저류가 발생함 나트륨 수치 증가로 수분 저류가 발생함 Noradrenaline and angiotensin II의 자극으로 말초 저항과 혈관수축이 강화되어 말초 부종과 심부전을 발생할 수 있음 |
2. Current Level of Evidence
The current state of evidence for RFS was recently summarized in a systematic review by Friedli et al.[2]
It is mainly based on case series and retrospective, cohort, and case-control studies.
지금까지 RCT는 거의 발표되지 않았다. 최근 전문가 합의로 입원 환자의 위험 인자, 발생률, 예방 조치 및 치료 권고사항이 정의 되었다.[3]
<Management and prevention of refeeding syndrome in medical inpatients: An evidence-based and consensus-supported algorithm>
| 일반적 | RFS can occur in medical inpatients and is associated with adverse outcome if left untreated. Risk assessment, establishment of a care plan, and monitoring of patients during nutritional therapy are important to reduce RFS-related morbidity. |
| RFS 위험도 평가 | Which medical inpatients are at risk for RFS? NICE guidelines criteria seem to be accurate for identification of patients at high risk for RFS with starvation being the most important risk factor. Other criteria such as older age, low baseline serum magnesium concentrations, high malnutrition risk scores (i.e., NRS 2002≥3 points), or overcoming severe catabolic disease together with aggressive use of enteral or parenteral feeding may be considered as additional risk factors for development of RFS. |
| 고위험군의 초기 치료 /RFS의 예방 |
How should high-risk patients be treated to prevent RFS? 전해질 보충: Patients at high risk for RFS should receive substitution of lower-than-normal electrolytes(magnesium<0.70–0.75 mmol/L, phosphate<0.80 mmol/L, potassium<3.5 mmol/L). 비타민 보충: Additionally, patients should be treated with vitamin B1(thiamine) and multivitamins. 초기 저칼로리 영양(점진적 증량): In those patients ,nutritional therapy should be started with reduced caloric targets and a slow increase to the full caloric amount over 5 to 10 d according to the individual risk category for RFS. 적절한 수액 치료: Fluid overload should be prevented by restricted use of fluid and sodium restricted diet within the first 7 d. We recommend prophylactic supplementation of electrolytes, thiamine, and minerals before initiation of nutritional support in patients at risk for RFS. 철분 결핍 환자에서는 초기 철분 보충은 권장하지 않음: No iron substitution within the first 7d even if patients have iron deficiency. |
| RFS 모니터링 | How should we monitor patients at risk for RFS? 영양 치료 도입 후 초기 72시간 동안 전해질 모니터링: Electrolyte concentrations should be monitored daily during the first 72 h of nutritional therapy with additional clinical examination to detect signs and symptoms of fluid overload in patients at risk for RFS. |
| RFS 진단 | Which diagnostic criteria should be used for RFS? Based on electrolyte concentrations and clinical symptoms, imminent and manifest RFS may be distinguished. Imminent RFS is present if shift in electrolytes (decrease of phosphate from baseline>30% or<0.6 mmol/L or any two other electrolyte shifts below normal range) occurs within 72 h after start of nutrition therapy, whereas manifest RFS is considered if any electrolyte shifts occur in conjunction with typical clinical symptoms. |
| RFS 치료 | How should we treat imminent or manifest RFS? 전해질 보충: In the case of imminent or manifest RFS, electrolyte supplementation should be started or adapted. 저칼로리 영양: If patients suffer from manifest RFS with edema, lung failure, or heart failure, the caloric target should be reduced as in high-risk patients and adequate treatment for those conditions is needed. |
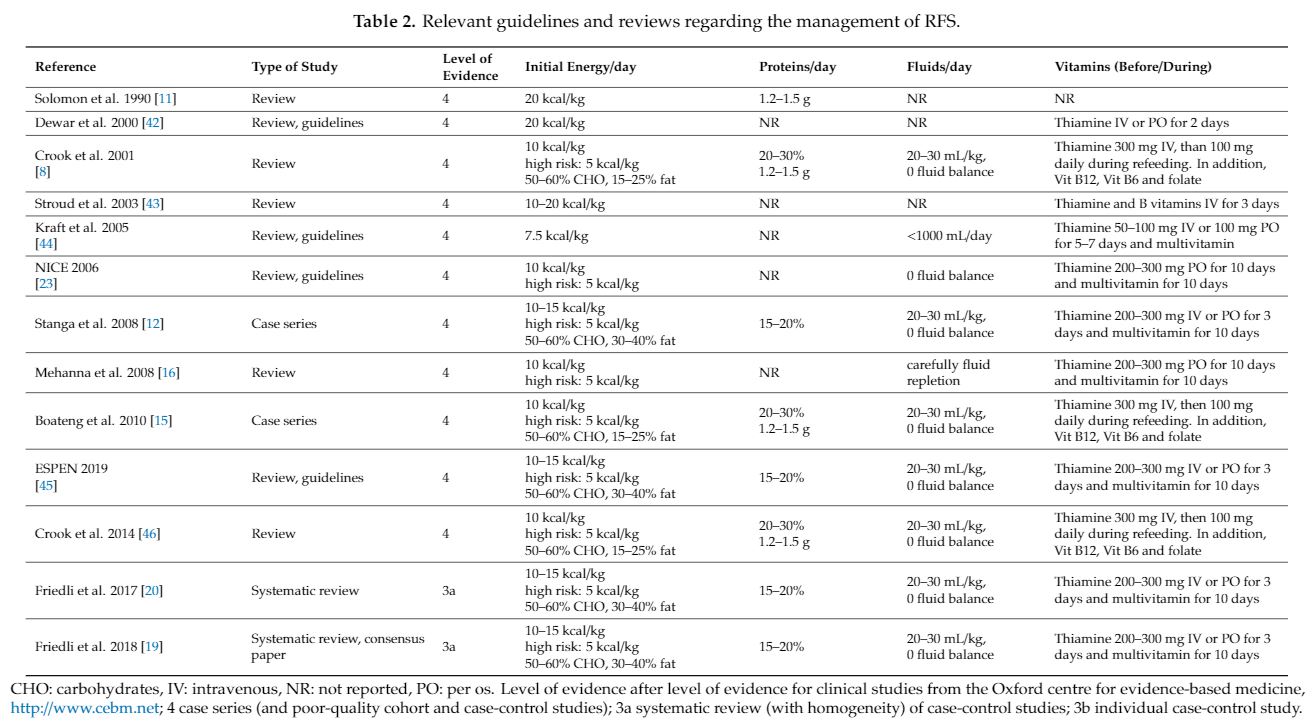
3. 예방
1) Nutritional Support Teams
영양 시작 단계 처음 72시간 내 발생하며 빠르게 진행될 가능성이 높기 때문에 이에 대한 빠른 인식이 중요하다.
2) Individual Risk Assessment
심각하고 잠재적으로 치명적인 합병증을 유발할 수 있지만 충분히 예방 가능한 상태이다.
RFS는 모둔 종류의 영양 개입(oral, enteral, or parenteral)d서 발생할 수 있다.
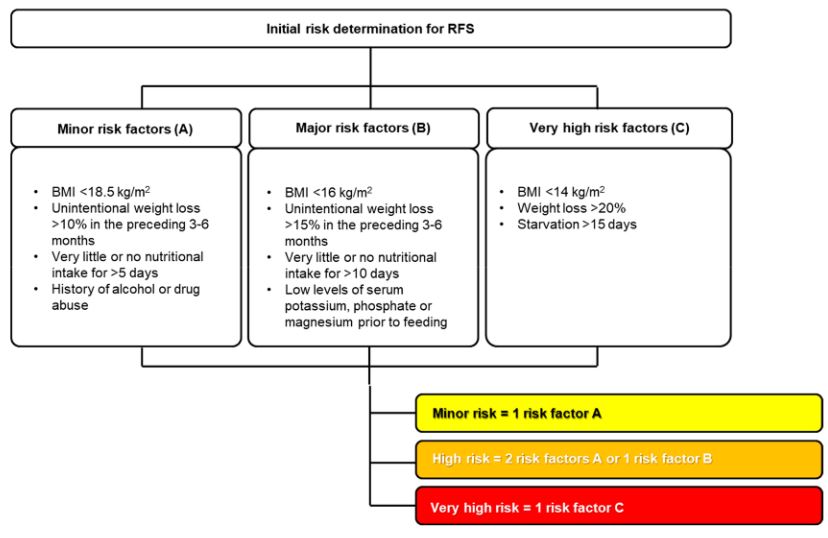
- Starvation
- Nutritional risk screening 2002 ≥ 3 points, polymorbidity, older age, and low serum magnesium (<0.7 mmol/L)
- Underlying diseases and conditions affecting nutrient absorption (e.g., short bowel syndrome, bariatric surgery, eating disorders)
- Chronic gastrointestinal symptoms (e.g., diarrhea, vomiting)
- Medical therapeutic interventions like hemodialysis or chemotherapy

4. 진단
주로 저인산혈증인 전해질 불균형은 여러 연구에서 RFS를 정의하는데 사용되었다.
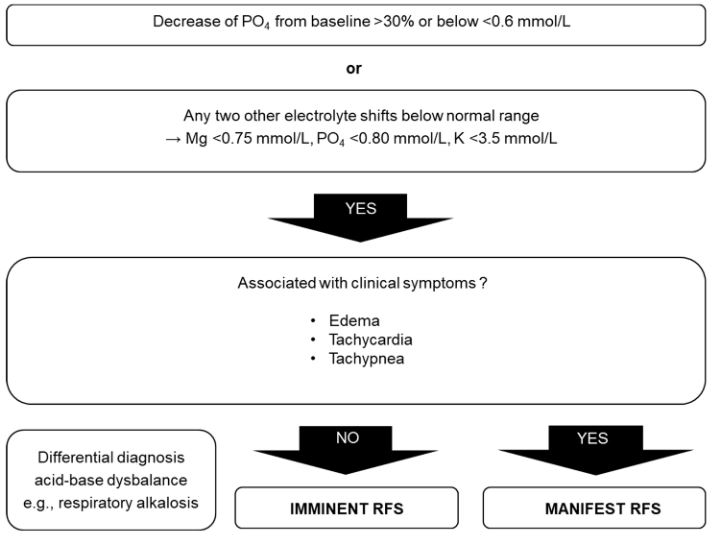
* 산-염기 균형 교란(Disturbance of the acid-base balance)은 저인산혈증을 유발할 수 있다. 예를 들어 급성 호흡성 알칼리증은 입원 환자에서 저인산혈증을 유발하는 가장 흔한 임상 경우이다.
종종 이뇨제(loop and thiazide diuretics) 사용으로 체액 감소, 전해질 감소(염소, 칼륨, 마그네슘)로 대사성 알칼리증이 발생하기도 한다. 저인산혈증은 대사성 알칼리증보다 호흡성 알칼리증에서 훨씬 더 뚜렷한 양상으로 나타난다.
5. 관리
전해질 보충, 티아민 투여, 저칼로리 공급 등 RFS에 대한 예방적 접근법을 다양한 시험들을 평가하였다. 제안된 영양 관리에 사용된 대부분의 연구는 observational and not interventional 전반적으로 낮은 수준의 증거(low level of evidence)였다.
Friedli 등의 체계적 검토에 포함된 45개 연구 중 일부는 인산염(phosphate) 보충이 효과적이라고 보고했다. 여러 연구에서 전해질 보충(electrolytes replacement)과 저칼로리 공급(hypocaloric feeding)의 RFS 위험 감소가 입증되었습니다. 또한 혈청 전해액의 면밀한 모니터링(close monitoring of serum electrolytes)은 RFS 위험 감소를 위한 추가 조치이다.
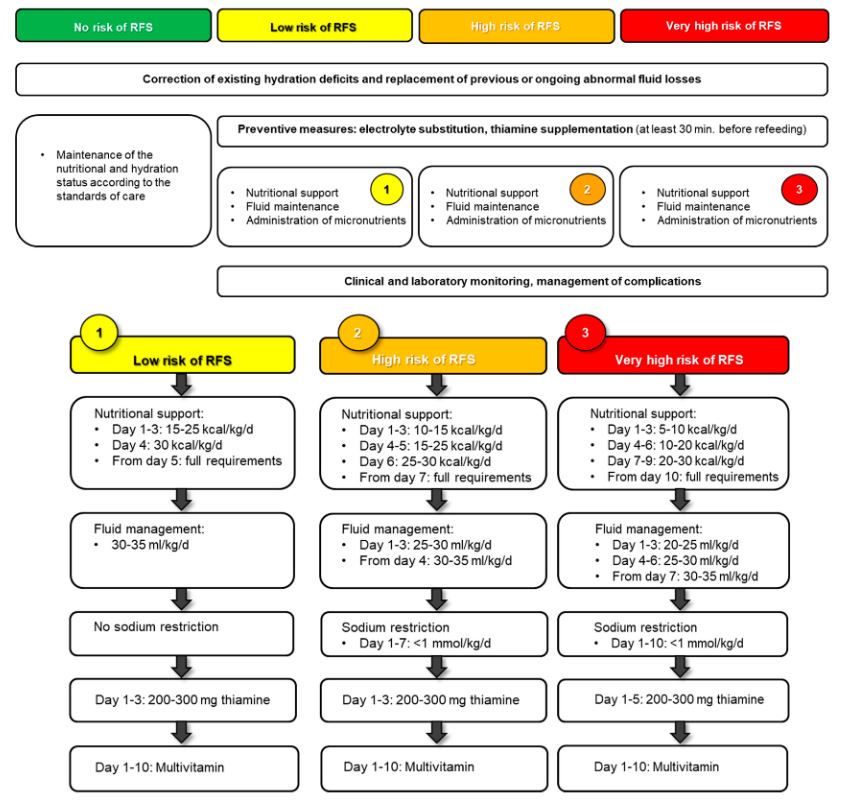
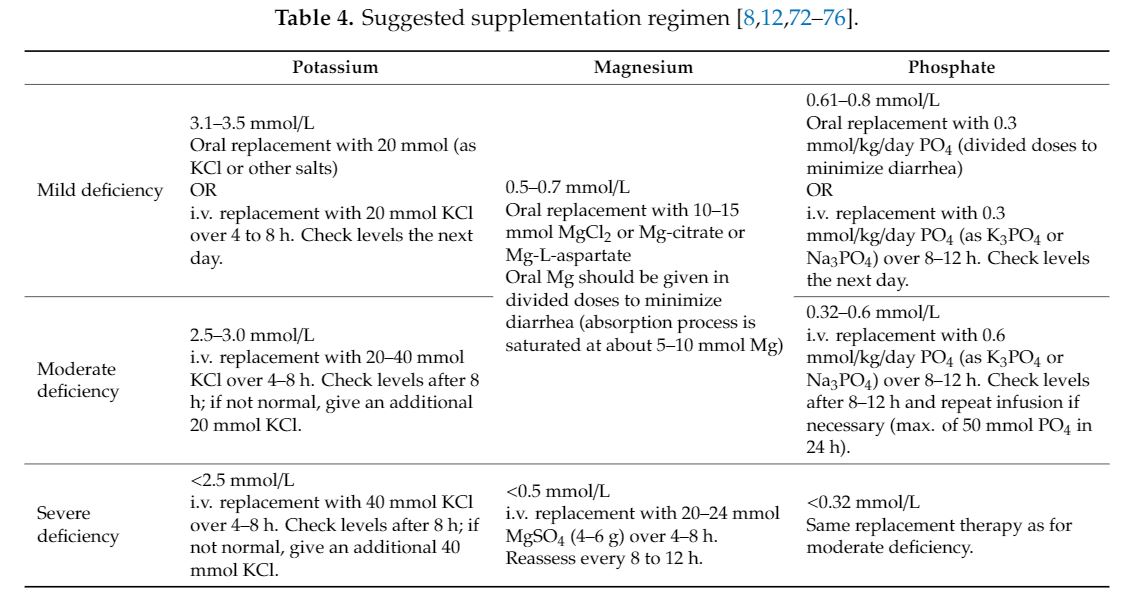
1) Macronutrients
초기 5–15 kcal/kg부터 시작
전체 에너지 요구량(칼로리 요구량)은 이전 위험 계층화에 따라 5-10일 이내에 충족
탄수화물 40-60%, 지방 30–40%, 단백질 15–20%
임상적으로 불안정한 RFS 환자의 경우 탄수화물 비율을 낮추는 것이 고려
최적의 영양 지원은 여전히 논란이 되고 있으며 일부 전문가와 과학자들은 영양실조와 관련된 해악(harm)에 대응하기 위해 영양지원의 더 빠른 증가를 권고(faster increase in nutritional support)
2) Fluids
Disturbance of the acid-base balance ⇨ hypophosphatemia 유발
Acute respiratory alkalosis is for example the most common clinical situation in which hypophosphatemia should be expected in hospitalized patients.
uncritical use of diuretics (loop and thiazide diuretics)는 전해질 불균형을 촉발하고 alkalosis을 촉진할 수 있음
체액이 감소하면 두 가지 방법으로 대사성 알칼리증이 유발됨
인산염의 감소는 대사성 알칼리증보다 호흡성 알칼리증에서 훨씬 더 두드러짐
일반적으로 하루 25–35 mL/kg의 유체 섭취는 적절한 수화 상태를 유지하기에 충분
3) Micronutrients
영양 불량 환자들은 세포 내 미세 영양소가 고갈되어 있음
초기 영양 치료 후, 비타민과 전해질은 세포 내로의 이동이 증가되면서 혈청 수치가 감소됨
인산염과 티아민의 보충이 특히 중요함
The prophylactic supplementation of high-dose thiamine (200–300 mg) at least 30 min before beginning refeeding is fundamental.
Iron should not be supplemented in the first week after the start of the nutritional therapy, even in the case of manifest iron deficiency.
6. 합병증
Important symptoms and clinical sequelae of RFS
| System | Symptoms |
| 심혈관계 | Tachycardia Arrhythmias Hypotension Congestive heart failure Shock Edemas Sudden death |
| 위장계 | Maldigestion and malabsorption Vomiting Constipation Abdominal pain |
| 골격근계 | Weakness Myalgia Rhabdomyolysis Osteomalacia |
| 호흡계 | Tachypnea Dyspnea Respiratory failure Ventilator dependency Diaphragm muscle weakness |
| 신경계 | Anorexia Paresthesia Tremor Wernicke encephalopathy Korsakoff syndrome Ataxia Tetany Delirium Seizures Coma |
| 대사계 | Hyperglycemia Metabolic alkalosis Metabolic acidosis Respiratory alkalosis Insulin resistance |
| 혈액계 | Thrombocytopenia Hemolysis Anemia Leukocyte dysfunction Decreased 2,3-DPG |
| 신장 | Acute tubular necrosis |
| 간 | Acute liver failure |
reference:
1) Reber, Emilie, et al. "Management of refeeding syndrome in medical inpatients." Journal of clinical medicine 8.12 (2019): 2202.
2) Friedli, Natalie, et al. "Revisiting the refeeding syndrome: results of a systematic review." Nutrition 35 (2017): 151-160.
3) Friedli, Natalie, et al. "Management and prevention of refeeding syndrome in medical inpatients: An evidence-based and consensus-supported algorithm." Nutrition 47 (2018): 13-20.
'👩⚕️Px 영역 > TPN·영양' 카테고리의 다른 글
| TPN 시작 시기(2) ESPEN : timing of initiating TPN (0) | 2021.07.25 |
|---|---|
| TPN 시작 시기(1) ASPEN : timing of initiating TPN, partial PN(supplement PN) 도입 여부 (0) | 2021.07.25 |
| 비타민 B1, thiamine의 임상적 사용: 급성 심부전, 각기병, 베르니케 증후군, 패혈증 (0) | 2021.07.05 |
| 지질함유제제의 stability(안정성): TPN 주입시간, SMOF lipid 주입시간, propofol 주입시간 (0) | 2021.04.24 |
| 경장 영양 시 고려사항: Hemodynamic stability, VIS(vasoactive–inotropic score) (0) | 2021.04.20 |


댓글